免疫组化简介
免疫组织化学又称免疫细胞化学,是指带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应 和组织化学的呈色反应,对相应炕原进行定性、定位、定量测定的一项新技术。它把免疫反应的特异性、组织化学的可见性巧妙地结合起来,借助显微镜(包括荧光显微镜、电子显微镜)的显像和放大作用,在细胞、亚细胞水平检测各种抗原物质(如蛋白质、多肽、酶、激素、病原体以及受体等)。
免疫组化基本原理
免疫组化技术是一种综合定性、定位和定量;形态、机能和代谢密切结合为一体的研究和检测技术。在原位检测出病原的同时,还能观察到组织病变与该病原的关系,确认受染细胞类型,从而有助于了解疾病的发病机理和病理过程。
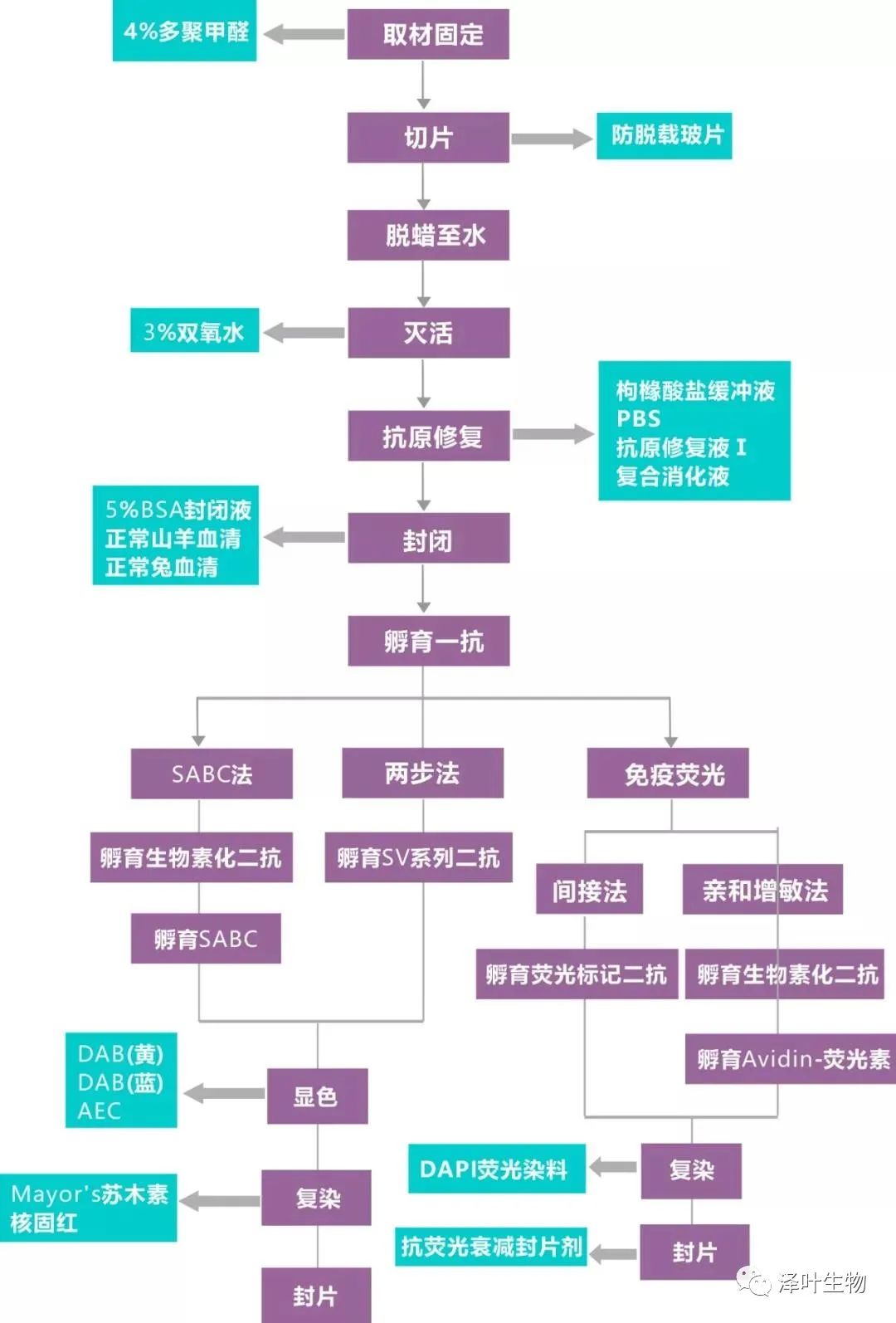
免疫酶组化技术是通过共价键将酶连接在抗体上,制成酶标抗体,再借酶对底物的特异催化作用,生成有色的不溶性产物或具有一定电子密度的颗粒,于普通显微镜或电镜下进行细胞表面及细胞内各种抗原成分的定位,根据酶标记的部位可将其分为直接法(一步法)、间接法(二步法)、桥联法(多步法)等,用于标记的抗体可以是用免疫动物制备的多克隆抗体或特异性单克隆抗体,最好是特异性强的高效价的单克隆抗体。直接法是将酶直接标记在第一抗体上,间接法是将酶标记在第二抗体上,检测组织细胞内的特定抗原物质。目前通常选用免疫酶组化间接染色法。
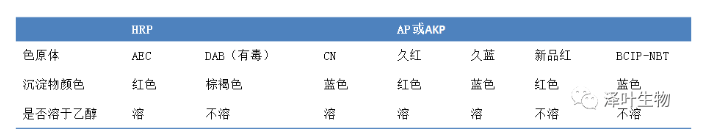
那么,显色常用的酶为辣根过氧化物酶(HRP),常用的显色底物为DAB(3,3’-二氨基联苯胺),偶尔用AEC(3-氨基-9-乙基咔唑)。碱性磷酸酶(AP或AKP)也是目前免疫诊断试剂最常用的标记酶之一,稳定性好、灵敏度高。
表1. 免疫组化(IHC)显色系统的选择
免疫组化注意事项
1. 组织取材
为避免蛋白丢失及组织受损引起的非特异试剂吸附,取材须快速(组织块也不宜太大)且要尽量避免人为损伤。
2. 固定
固定要及时、彻底,但也不能固定过久。实验证明甲醛固定时间越久的组织越容易出现自发荧光及非特异性染色。一般以 12~36 小时最好。
3. 石蜡片与冰冻片的选择
石蜡片制作对设备要求较冰冻片低,组织结构更好,保存条件简单时间也久。但对部分蛋白有较强烈的破坏作用,对蛋白保护较冰冻片差。冰冻片对蛋白的保护较石蜡片好,制作起来也较快。
4. 灭活
过氧化物酶(HRP)系统的一定要做内源性过氧化物酶的灭活,而对于碱性磷酸酶(AP)系统和免疫荧光这个步骤不需要做。
5. 抗原修复
不同的样本、不同的蛋白其最佳的抗原修复方式会有所区别,热修复(酸性修复液(柠檬酸盐修复液)、碱性修复液(EDTA 修复液)及酶修复(蛋白酶)都可做尝试。对于陈旧的样本要增加修复强度,比如延长修复时间。
6. 封闭
常用的封闭液有 5% BSA 和血清。BSA 是通用型的封闭液。血清应选择与二抗同源的血清。
7. 抗体孵育
一抗一定要与实验及样本匹配的,孵育条件以 4 ℃ 过夜最佳。二抗应匹配一抗,37 ℃ 孵育半小时即可。
8. 显色
DAB 显色建议在镜下控制反应时间,在阳性及背景之间选择平衡点。
免疫组化常见问题分析
1.脱片产生的原因有哪些
1、烤片时间不够,或温度不够,可以延长烤片时间和提高烤片温度;
2、多聚赖氨酸玻片质量的问题。
3、组织切的不好,切片机的问题例如比较老的旧的机器切的厚或者不均匀,或者切片者手法不好等。
4、修复的问题:抗原修复的时候高压时间过长了,或者放进100度的修复液时手法不好,咚的一声就丢进去了,这样超容易脱片。此外,用EDTA修复比柠檬酸容易脱片,但是你要用到EDTA的时候也没办法,只有从另外的问题上着手。
5、操作的时候甩的太猛了,有脱片嫌疑的片子最好不甩或轻轻甩,用卫生纸从边缘上慢慢吸水。
6.组织的问题,我用的组织癌症的很多,越是癌症组织有坏死之类越容易脱。
2.边缘效应
1、组织边缘与玻片粘贴不牢,边缘组织松脱漂浮在液体中,每次清洗不易将组织下面试剂洗尽所致. 解决办法:制备优质的胶片(APES或多聚赖氨酸),切出尽量薄的组织切片,不厚于4微米,组织的前期处理应规范,尽量避免选用坏死较多的组织;
2、切片上滴加的试剂未充分覆盖组织,边缘的试剂容易首先变干,浓度较中心组织高而致染色深。解决办法:试剂要充分覆盖组织,应超出组织边缘2mm。用组化笔画圈时,为了避免油剂的影响,画圈应距组织边缘3-4mm。
3.切片染色后背景太深,如何区分特异性sing与非特异性着色
全片着色是指整个切片全都染上了颜色,着色的强度可深可浅,总之,分不清那些组织是阳性那些组织是阴性。出现这种现象的原因有:
(1)抗体浓度过高:一抗浓度过高是常见的原因之一。解决办法是,每次使用新抗体前应当对其工作浓度进行测试,使每一抗体个体化,找到适合自己实验室的理想工作浓度,既使是即用型的抗体也应如此,不能只简单的按说明书进行染色。
(2)抗体孵育时间过长或温度较高:解决办法是,严格执行操作规程,最好随身佩带报时表或报时钟,及时提醒,避免因遗忘而造成时间延长。现在流行的二步法(Polymer)敏感性很高,要求一抗孵育的时间不是传统的1小时,而是30分钟,因此,要根据染色结果进行调整。
(3)DAB变质和显色时间太长:DAB最好现用现配,如有沉渣应进行过滤后再用。配制好的DAB不应存放时间太长,因为在没有酶的情况下,过氧化氢也会游离出氧原子与DAB产生反应而降低DAB的效力,未用完的DAB存放在冰箱里几天后再用这种似乎节约的办法是不可取的。DAB的显色最好在显微镜下监控,达到理想的染色程度时立即终止反应。不过当染色片太多时或用染色机时,这样做似乎不现实,但至少应对一些新的或少用的抗体显色时进行监控,避免显色时间过长。
(4)组织变干:修复液溢出后未及时补充液体、染色切片太多、动作太慢、忘记滴液、滴液流失等都是造成组织变干的原因。解决的办法是操作要认真仔细,采用DAKO笔或PAP Pen在组织周围画圈,可以有效的避免液体流失,也能提高操作速度。
(5)切片在缓冲液或修复液中浸泡时间太长(大于24小时):原因上不清楚,但现象存在。有的实验室喜欢前一天将切片脱蜡至修复,第二天加抗体进行免疫组化染色,如果将装有切片和修复液的容器放在4ºC冰箱过夜,对结果无明显影响,如果放在室温,特别是炎热的夏天,会出现背景着色,因此,不可存放时间太长。
(6)一抗变质、质量差的多克隆抗体:注意抗体的有效期,过期的抗体要麽不显色要麽背景着色。用新买的抗体时最好设立阳性对照和用使用过的抗体作比较。
4.免疫组化染色呈阴性结果
1、抗体浓度和质量问题以及抗体来源选择错误;
2、抗原修复不全,对于甲醛固定的组织必须用充分抗原修复来打开抗原表位,以利于与抗体结合;建议微波修复用高火4次*6min试试。有人做过实验,这是最佳的时间和次数。若不行,还可高压修复;
3、组织切片本身这种抗原含量低;
4、血清封闭时间过长;
5、DAB孵育时间过短;
6、细胞通透不全,抗体未能充分进入胞内参与反应;
7、开始做免疫组化,我建议你一定要首先做个阳性对照片,排除抗体等外的方法问题。
5.背景
1、考虑一抗浓度高;
2、然后调整DAB孵育时间;
3、也要考虑血清封闭时间是否过短;
4、适当增加抗体孵育后的浸洗次数和延长浸洗时间等。
 在线客服1号
在线客服1号




