琼脂糖
英文名:Agarose
储存条件:RT
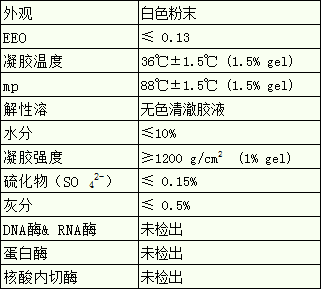
琼脂糖是由1,3连结的β-D-半乳呋喃糖和1,4连结的3,6-脱水α-L-半乳呋喃糖相间联结而成。琼脂糖具有亲水性,并几乎完全不存在带电基团,极少吸附生物大分子也极少引起其变性,是理想的惰性载体。琼脂糖在水中一般加热到90℃以上溶解,温度下降到35-40℃形成良好的半固体状的凝胶。琼脂糖凝胶是最常用的分离介质,用作电泳和层析载体,分离生物大分子(核酸、蛋白、多糖等)。
琼脂糖凝胶的优点:
1、样品无需预处理,电泳操作简单,电泳速度快。
2、凝胶结构均匀,电泳图谱清晰,分辨率高,重复性好。
3、凝胶透明无紫外吸收,电泳结果可直接用紫外光灯下监测。
4、易染色,样品易洗脱,便于定量测定。制成干膜可长期保存。
琼脂糖凝胶的制备方法:
1、根据电泳需要,配制电泳缓冲液。
2、准确称量的琼脂糖加入三角瓶,加入电泳液(1%琼脂糖凝胶,即为1g琼脂糖,加入100 ml 1×TAE)。总液体量不宜超过三角瓶的50%容积
3、微波炉高火加热至沸腾,保持30秒,戴上防热手套,小心摇动三角瓶,重悬未溶解颗粒,再次高火加热1-2分钟,直至琼脂糖完全溶解。
注:加热时如胶液剧烈沸腾发泡,停止加热。微波炉中加热时间不宜过长。
4、溶液冷却至60℃左右,可加入EB溶液(终浓度为0.5 ug/ml,其它核酸染料也可),并充分混匀。
5、将琼脂糖溶液倒入制胶模中,在适当位置插上梳子。凝胶厚度一般在3-5 mm之间。
6、室温下自然凝固(约30-60分钟),然后放置于电泳槽中进行电泳。
注: 凝胶不立即使用,用保鲜膜将凝胶包好后在4℃保存,可保存2-5天。
琼脂糖浓度与 DNA 分离范围

微波炉溶解琼脂糖时,胶液剧烈沸腾冲溢出三角锥瓶怎么办?常见问题及解决办法
1、总液体量不宜超过三角锥瓶的50%容量。
2、胶液浓度为2%以上的请设置中火加热。
3、胶液剧烈沸腾时,停止加热,戴上防热手套小心摇动三角瓶,然后再次加热至沸腾,直至琼脂糖完全溶解胶液清澈。
琼脂糖电泳图像背景模糊的原因及解决办法
琼脂糖没有完全溶解会造成电泳图像背景模糊不清。完全溶解的琼脂糖,三角瓶内壁应没有粘附琼脂糖颗粒。
DNA条带模糊,拖尾的原因及解决办法
1、DNA降解。样品应避免放置时间过长,避免核酸酶污染。
2、上样量过多。减少上样量。
3、电泳缓冲液失效。多次使用的电泳缓冲液,离子强度降低,pH值上升,缓冲能力减弱,影响电泳效果。建议更换电泳缓冲液。
4、电泳条件不合适。电泳时电压不应超过20V/cm,温度<30℃,超长DNA链,温度应<15℃。
5、DNA含盐过高。电泳前通过乙醇沉淀去除过多的盐。
6、蛋白污染。电泳前抽提去除蛋白。
7、DNA变性。电泳前勿加热,用20mM NaCl缓冲液稀释DNA。
DNA条带淡弱或无条带的原因及解决办法
1、上样量不够。增加上样量。
2、DNA降解。避免DNA的核酸酶污染。
3、DNA跑出凝胶。缩短电泳时间,降低电压,增强凝胶浓度。
4、分子大小相近的DNA条带不易分辨。增加电泳时间,使用正确的凝胶浓度。
5、DNA 变性。电泳前请勿高温加热DNA链,用20mM NaCl Buffer 稀释DNA。
6、DNA链超长,常规凝胶电泳不合适。在脉冲凝胶电泳上分析。
DNA Marker条带扭曲的原因及解决办法
1、配制凝胶的缓冲液和电泳的缓冲液,不是同时配制的。使用同时配制的缓冲液,缓冲液高过凝胶1-2mm。
2、电泳时电压过高。可以在电泳前15分钟用较低电压(3V/cm),等条带出孔后,再调高电压。
3、尽量慢慢加样,等样品自然沉降后再加电压。
我司所售出产品仅供于科研研究用途(非临床科研研究),每次销售产品行为都适用于我司网上所列明的通用销售条款。
 在线客服1号
在线客服1号












